
ワード版は以下からダウンロードできます。
概要
塩酸の電気分解で陰極に水素、陽極に塩素が発生した理由は電気を帯びているからだと気づき、水溶液中では原子には電気が帯びる(イオンになる)ことを理解する。
2年時の静電気ではプラスとマイナスが引き合ったことを思い出し、塩酸でも同じようにプラスとマイナスで引き合っていることを想起させる。
陰極(マイナス)で水素が発生したので水素はプラスの電気を持っており、陽極(プラス)で塩素が発生したので塩素はマイナスの電気を持っていることを想起させる。
塩酸の電気分解で電気を帯びた電子(イオン)の存在があることに気づき、授業者の説明により原子・イオンの構造を理解させたい。
導入
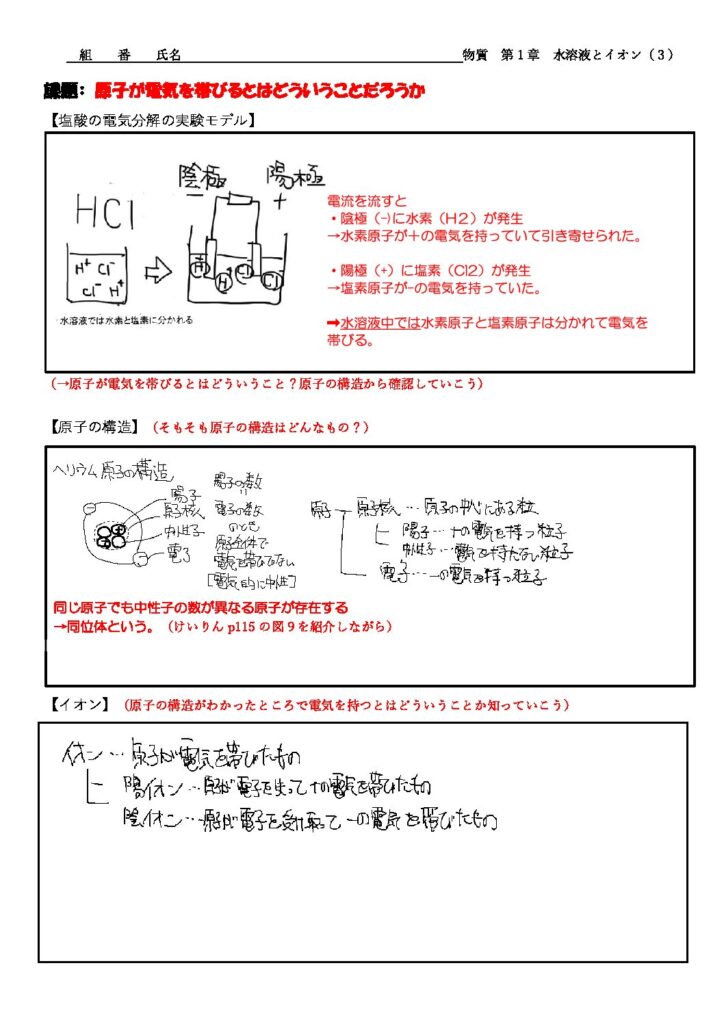
薄い塩酸を電気分解すると、両極付近にはそれぞれ何が生じただろうか。
「陰極に水素、陽極に塩素が発生した」
なぜ陰極(マイナス)に水素、陽極(プラス)に塩素が発生した(引き寄せられた)のだろう。
マイナス、プラス、引き寄せられたと言葉を選ぶことで、静電気を想像させる。
「水素がプラス、塩素がマイナスを持っているからだろうか?」
説明
塩酸は水溶液中で水素原子と塩素原子に分かれており、水素原子は+の電気を帯びており、塩素原子は-の電気を帯びていることを説明する。
原子が電気を帯びるとはどういうことだろうか。まずは原子の構造から確認していこう
原子の構造
原子の構造とはどんなものか説明する。同位体についてもけいりんp115の図9を参考に紹介する。
イオン
イオンについて説明する。
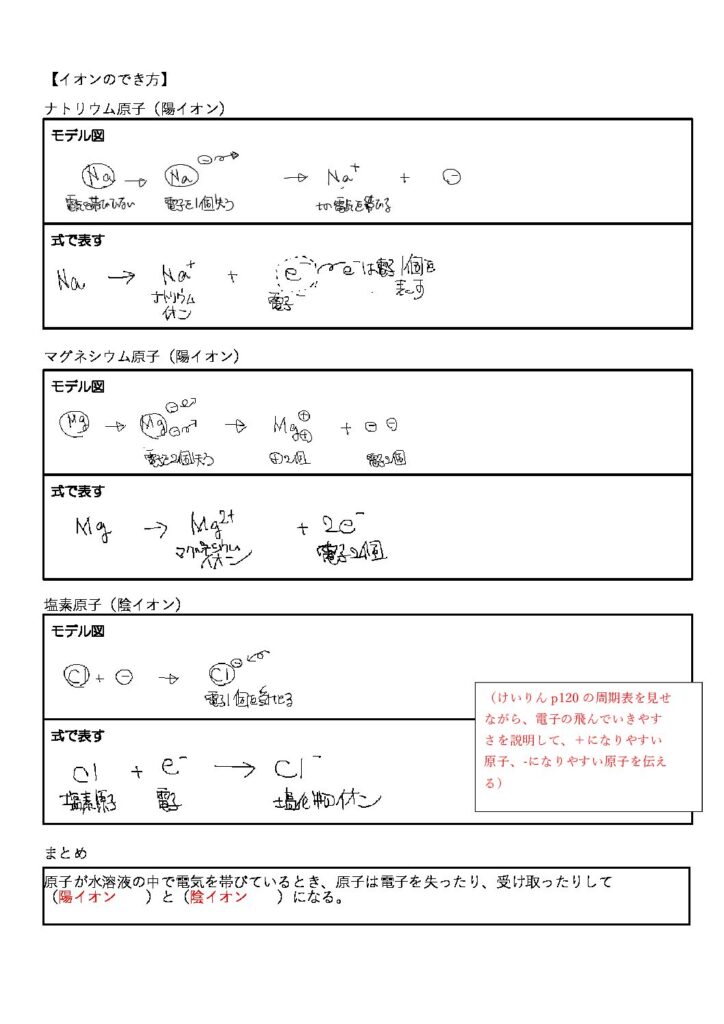
イオンのでき方
モデル図を用いながら、イオンのでき方について説明する。電子をe-であらわすことも触れる。余裕があれば、けいりんp120の電子配置の図を示しながら、陽イオンになりやすい原子、陰イオンになりやすい原子について説明する。
まとめ
原子が水溶液の中で電気を帯びているとき、原子は電子を失ったり、受け取ったりして陽イオンと陰イオンになる。

